Physique et Chimie au lycée Jan Neruda de Prague
Vive les sciences !
Accueil > Cours de Chimie > 5ième année > A Transformations des systèmes chimiques > 03 Transformations associées à des réactions acido-basiques > 5C2011 TP virtuel sur la spectrophotométrie (2ième partie)
5C2011 TP virtuel sur la spectrophotométrie (2ième partie)
mercredi 3 octobre 2012 par
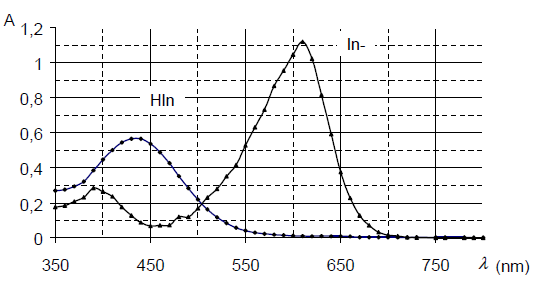
Le bleu de bromothymol n’absorbe pas les mêmes longueurs d’ondes quand le pH est acide ou basique, suivant qu’on trouve sa forme acide HIn (In : abréviation de Indicateur coloré) ou sa forme basique In-.
Remarques :
a) Comme nous n’avons pas de spectrophotomètre, j’utilise le spectre d’absorption d’un TP similaire du site http://www.physagreg.fr même si la valeur maximale mesurée dans le TP est 1,094 au lieu de 1,12.
Les coefficients d’extinction molaire des 2 espèces pour les deux longueurs d’ondes sont calculés à partir des absorbances lues sur le graphique ci-dessous avec la concentration c = (1/11).3.10-4 = 2,73.10-5 mol.L-1.
Les coefficients d’extinction molaire des 2 espèces pour les deux longueurs d’ondes sont calculés à partir des absorbances lues sur le graphique ci-dessous avec la concentration c = (1/11).3.10-4 = 2,73.10-5 mol.L-1.
b) En utilisant le fichier.xls que j’ai créé pour les domaines de prédominances, j’ai recalculé les valeurs des absorbances que nous aurions mesurées.
Après avoir lu les réflexions préalables de la page 139, vous avez retenu que :
- La concentration c de la solution est c = a + b avec a la concentration de la forme acide et b la concentration de la forme basique.
- Pour une traversée de l = 1cm, l’absorbance d’une espèce pour une longueur d’onde vaut
A = ε.l.c si la concentration est faible. Ici l = 1cm donc A = ε.c.1. - Si pH << pKA alors seule la forme acide Hln existe donc [HIn] = c et A = εA.c.1 donc εA = AA/c
Si pH >> pKA alors seule la forme basique Hl- existe donc [HI-] = c et A = εB.c.1 donc εB = AB/c - Pour λ1 = 430 nm on a une absorbance de 0,57 à pH = 4 donc εA = AA/c = 0,57/2,75.10-5 = 2,07.104 L.mol-1.cm-1 et une absorbance de0,10 à pH = 10 donc εB = AB/c = 0,10/2,75.10-5 = 3,64.103 L.mol-1.cm-1.
De même pour λ2 = 620 nm on a pH = 4, ε’A = 0 L.mol-1.cm-1 (pas d’absorbance mesurée) et à pH = 10 donc ε’B = A’B/c = 1,12/2,75.10-5 = 4,07.104 L.mol-1.cm-1. - Lorsque la solution est verte, les deux formes du BBT sont présentes et absorbent certaines couleurs. La courbe présentera donc deux maxima.
- L’absorbance est d’après la loi Beer-Lambert la somme des absorbances de qui donne
A = εA.l.a + εB.l.b avec l = 1cm et a + b = c et je m’arrête ici de suivre le TP du livre de Nathan.
Le but du TP virtuel est de retrouver à partir des absorbances mesurées la valeur de la concentration de l’une des deux formes en fonction du pH, pas de se compliquer la vie avec des équations mathématiques...
Ouvrez maintenant le fichier TP_Virtuel_2.xls et compléter les deux dernières colonnes pour tracer le diagramme de prédominance.
Documents joints
- TP_Virtuel_2.xls (Excel – 33 ko)
Contact |
Se connecter |
Plan du site |
Mentions légales |
 RSS 2.0 |
Haut de page |
RSS 2.0 |
Haut de page |
 |
|
Physique et Chimie au lycée Jan Neruda de Prague (Lycée Bilingue Jan Neruda)