Accueil > Cours de Chimie > 5ième année > A Transformations des systèmes chimiques > 04 Titrages pH-métriques > 5D 2010-02-04 Titrage (Corrigé)
5D 2010-02-04 Titrage (Corrigé)
lundi 8 février 2010 par
L’ammonitrate est un engrais azoté solide, bon marché, très utilisé dans l’agriculture. Il contient du nitrate d’ammonium NH4NO3(s). Sur le sac on peut lire " pourcentage massique en élément azote N 34,4 %". Afin de vérifier l’indication du fabricant, on dose les ions ammonium NH4+ présents dans l’engrais à l’aide d’une solution de’hydroxyde de sodium Na+(aq) + HO-(aq).
Couples acide /base : NH4+ (aq) /NH3(aq) ; H2O (l) / HO-(aq).
N : 14 ; H : 1 ; O : 16 g/mol.
Le nitrate d’ammonium est très soluble dans l’eau, sa dissolution dans l’eau est totale selon la réaction :
NH4NO3(s) = NH4+ (aq) + NO3- (aq).
Etude de la réaction de titrage :
l’équation support du titrage est :
NH4+ (aq) +HO-(aq) = NH3(aq) + H2O (l)
- L’ion ammonium est-il un acide ou une base selon Brönsted ? Justifier.
- On introduit dans un becher un volume v= 20,0 mL d’une solution contenant des ions ammonium à la concentration molaire apportée c= 0,15 mol/L et un volume v1 = 10,0 mL d’hydroxyde de sodium à la concentration molaire apportée c1 = 0,15 mol/L. Le pH de la solution est 9,2.
- Etablir le tableau d’avancement ( sans valeur numérique).
- Calculer les quantités de matière initialement introduites dans le becher.
- A partir de la mesure du pH, déterminer la quantité de matière d’ions hydroxyde à l’état final et montrer que l’avancement final est xf= 1,5 10-3 mol.
- Calculer la valeur de l’avancement maximal.
- Que peut-on dire de la transformation ?
L’ion ammonium NH4+ (aq) est un acide selon Brönsted : cet ion est susceptible de libérer un proton H+ selon :
NH4+ (aq) = NH3(aq) + H+
Tableau d’avancement :
Quantités de matière initialement introduites dans le becher :
quantité de matière (mol) = concentration (mol/L)*volume (L)
n(NH4+)= cv = 0,15* 20 10-3 = 3,0 10-3 mol.
n(HO-)= c1v1 = 0,15* 10 10-3 = 1,5 10-3 mol.
Quantité de matière d’ions hydroxyde à l’état final :
[H3O+(aq)] = 10-pH ;
[H3O+(aq)] [HO-(aq)]= 10-14 ;
[HO-(aq)]= 10-14 / [H3O+(aq)] = 10-14 /10-pH =10-14+pH
[HO-(aq)]=10-14+9,2 = 10-4,8 =1,6 10-5 mol/L
Volume de la solution dans le becher : 30 10-3 L.
n(HO-) f = 1,6 10-5* 30 10-3 = 4,8 10-7 mol.
avancement final xf :
c1v1 -xf = 4,8 10-7 ; xf =c1v1 -4,8 10-7 = 1,5 10-3 -4,8 10-7 ;
xf =1,5 10-3 mol.
Avancement maximal xmax :
Si NH4+ (aq) est en défaut : cv-xmax=0 ; xmax = cv = 3 10-3 mol
Si HO-(aq) est en défaut : c1v1-xmax=0 ; xmax = c1v1 = 1,5 10-3 mol
Retenir la plus petite valeur : xmax=1,5 10-3 mol.
Taux d’avancement final t :
t =xf /xmax=1 : la transformation est totale.
Titrage pHmétrique :
Une solution d’engrais S est obtenue en dissolvant m =6,0 g d’engrais dans une fiole jaugée de volume V= 250 mL. On prépare ensuite deux bechers B1 et B2 suivants :
Les solutions contenues dans les bechers sont titrées par une solution d’hydroxyde de sodium de concentration molaire apportée cB= 0,20 mol/L.
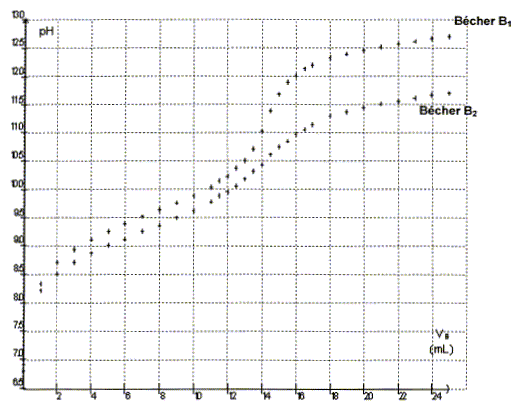
On obtient les courbes pH=f(Va) suivantes :
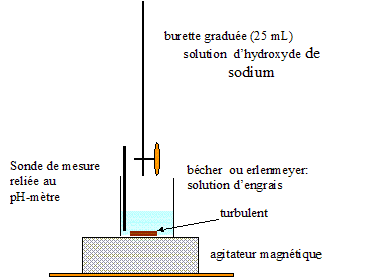
- Schématiser et légender le montage permettant de réaliser le titrage pHmétrique.
- Détermination du point équivalent :
- Quelle courbe permet de déterminer les coordonnées du point équivalent avec le plus de précision ? Justifier.
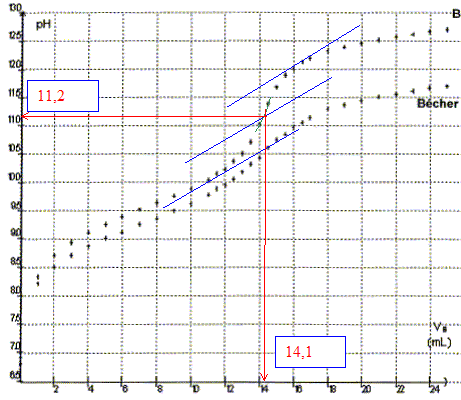
- Déterminer graphiquement les coordonnées du point équivalent.
- L’ajout d’eau déminéralisée a t-il une influence sur le volulme versé à l’équivalence ? Justifier.
Montage permettant de réaliser le titrage pHmétrique :
La courbe présentant le plus grand saut de pH, au voisinage de l’équivalence, permet de déterminer les coordonnées du point équivalent avec le plus de précision .
L’ajout d’eau déminéralisée n’a pas d’influence sur le volulme versé à l’équivalence : l’eau déminéralisée n’apporte pratiquement aucun ion hydroxyde et oxonium.
La méthode des tangentes appliquée à l’autre courbe conduit à la même valeur du volume équivalent.
Autre méthode plus précise pour déterminer le point équivalent :
A l’aide d’un système informatique, tracer la courbe dpH/dVa : celle-ci présente un pic à l’équivalence.
Détermination du pourcentage massique en élément azote dans l’engrais :
- Définir l’équivalence d’un dosage.
- Quelles sont les espèces chimiques présentes à l’équivalence dans le milieu réactionnel ? Justifier le pH basique de la solution en ce point.
- En vous aidant éventuellement d’un tableau descriptif de l’évolution de la réaction, déterminer la relation entre la quantité d’ions ammonium dosés n0(NH4+) et la quantité d’ion hydroxyde versé à l’équivalence ne( HO-).
- En déduire la valeur de n0(NH4+).
- Quelle quantité de matière d’ion ammonium n(NH4+) a t-on dans la fiole jaugée de 250 mL ? En déduire la quantité de matière de nitrate d’ammonium présente dans cette fiole.
- Quelle masse d’azote y a t-il dans une mole de nitrate d’ammonium ? En déduire la masse d’azote présente dans l’échantillon.
- Le pourcentage massique en élément azote est le rapport entre la masse d’azote présente dans l’échantillon et la masse de l’échantillon. Calculer ce pourcentage massique et le comparer à l’indication du fabricant. Conclure.
Equivalence d’un dosage :
A l’équivalence, les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques. Avant l’équivalence l’un des réactifs est en excès ; après l’équivalence, l’autre réatif est en excès.
Espèces chimiques présentes à l’équivalence dans le milieu réactionnel :
H2O ; NH3(aq) ; Na+(aq) ; NO3-(aq) ( ces deux ions sont spectateurs)
HO-(aq), le pH étant supérieur à 7.
La présence de la base NH3(aq) donne un milieu basique.
Relation entre la quantité d’ions ammonium dosés n0(NH4+) et la quantité d’ion hydroxyde versé à l’équivalence ne( HO-).
D’après la définition de l’équivalence : n0(NH4+)=ne( HO-).
n0(NH4+)= CB Véq = 0,2*14,1 10-3 = 2,8 10-3 mol.
Quantité de matière d’ion ammonium n(NH4+) contenu dans la fiole jaugée de 250 mL :
Le volume de la fiole jaugée ( 250 mL) est 25 fois plus grand que celui de la prise d’essai ( 10 mL) :
n(NH4+) =25*n0(NH4+)= 25*2,8 10-3 = 7,0 10-2 mol.
Quantité de matière de nitrate d’ammonium présente dans cette fiole :
NH4NO3(s) = NH4+ (aq) + NO3- (aq).
Les coefficients stoechiométriques conduisent à : 7,0 10-2 mol de nitrate d’ammonium.
Masse d’azote dans une mole de nitrate d’ammonium NH4NO3 :
Cette formule brute contient deux fois l’élément azote ; en conséquence 2*14 = 28 g d’azote par mole.
Masse d’azote présente dans l’échantillon :
7,0 10-2 * 28 = 1,96 g ( réponse : 2,0 g).
Le pourcentage massique en élément azote est le rapport entre la masse d’azote présente dans l’échantillon et la masse de l’échantillon.
Pourcentage massique : 2 /6 = 0,333 soit 33 %.
L’écart relatif avec l’indication du fabricant est : (34,4-33,3 )*100 / 34,4 = 3,2 %
A 3 % près l’indication du fabricant et le résultat du titrage sont identiques.