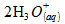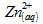Accueil > Cours de Chimie > 3ième année > C Transformation de la matière > 24 Bilan de matière _ Initiation à l’avancement > 3CD Chimie Chapitre 23 et 24
3CD Chimie Chapitre 23 et 24
vendredi 3 mai 2013 par
La
réaction chimique et les bilans de matiere
I]Systeme chimique, réaction et transformation chimique

A l’échelle macroscopique, on considere un systeme
chimique constitué d’une masse m1 = 0,50g de
métal zinc en poudre et d’un volume V2 = 10 mL d’une
solution d’acide chlorhydrique concentrée a c2 = 5
mol.L-1.
1)Etat Initial
On décrit l’état initial du systeme
en précisant l’état physique des réactifs (solide, liquide ou aqueux,
gaz), leur quantité en mol et la température et la pression.
Zinc (solide) :
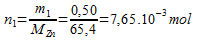
Ion
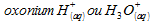 :
:
l’acide chlorhydrique est un acide fort donc il est completement
dissocié par l’eau suivant la réaction
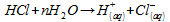 :
:
n2 = nHCl = n(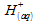 )
)
= c . V = 5·10·10-3 = 50 mmolLes ions chlorure
n’interviennent pas dans la réaction donc ne font pas partie des
réactifs. (La réaction aurait été la meme avec l’acide
sulfurique H2SO4 par exemple.)La température initiale est de
25°C et la pression est la pression atmosphérique du jour,
proche de la pression atmosphérique normale de 1013 hPa.
2)La réaction a lieu :
 On
On
observe immédiatement une effervescence (production de gaz)
importante dans le tube a essai qui se met a chauffer.

On place rapidement un bouchon percé
avec un tube de dégagement sur l’éprouvette et on attend quelques
instants que tout l’air présent initialement dans le tube a
essai soit évacué par le gaz produit. En tenant l’éprouvette avec un
chiffon, on approche l’extrémité du tube a essai de la flamme
du bec Bunsen : le gaz produit brule avec une flamme
jaune.
On peut aussi enlever le tube de
dégagement et boucher l’éprouvette avec un doigt. Apres
quelques instants, on approche l’extrémité de l’éprouvette du bec
Bunsen et on entend une petite détonation. Le gaz produit est du
dihydrogene H2 suivant la réaction :
-
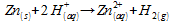
1 mol
2 mol
1 mol
1mol

3)Etat Final
Le gaz produit par la réaction s’est en partie
échappé et a en partie réagit avec le dioxygene de l’air pour
faire la flamme jaune et la petite détonation. Comme on ne
s’intéresse qu’a la premiere transformation chimique,
on imagine que le systeme final contient encore ce gaz et
qu’on a laissé la température et la pression revenir aux valeurs
initiales.
On observe que tout le zinc solide a disparu quand
l’effervescence a cessé. Une goutte de bleu de bromothymol dans le
tube a essai colore le liquide en jaune et montre qu’il reste
de l’acide. On dira que le zinc était en défaut (il en
manquait) et que l’acide était en exces (il y en avait
trop).


Le nombre de moles d’ions zinc Zn2+
formées est égal au nombre de moles de zinc consommées :
n3
= n1 = 7,65.10-3 molCalculons le volume de gaz H2
formé : n4 = n3 d’apres
l’équation de la réaction donc
V(H2)= n4.Vmolaire
= 7,65.10-3·25 = 0,19 L = 190mLIl reste des ions oxonium H3O+ :
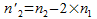
d’apres l’équation de la réaction, ce qui donne
n’2
= 50 – 2·7,65 = 34,7 mmol.
4)Transformation ou réaction chimique ?
a)La réaction chimique est un modele.
L’équation de la réaction n’explique pas ce qui se
passe a l’échelle microscopique (mécanisme
réactionnel). Dans notre
exemple, on n’explique pas comment les ions 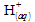
arrachent des électrons au métal zinc ni comment 2 ions 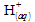
semblent arriver en meme temps pour qu’on puisse obtenir une
molécule de dihydrogene H2.
-
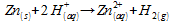
1 mol
2 mol
1 mol
1mol
b)L’équation de la réaction doit etre équilibrée.
Antoine Lavoisier aurait dit "Rien ne se
perd, rien ne se crée, tout se transforme". Lors d’une réaction
chimique, des liaisons sont rompues (étape endoénergétique), d’autres
sont créées (étape exoénergétique) mais on ne perd ni ne crée
d’électrons (conservation de la charge)
et les atomes restent les memes (conservation de la
masse ou plutôt en chimie, des
atomes).
On ajuste donc
les nombres "stoechiométriques"
(du grec stoicheion élément et metrein mesure), pour respecter les
conservations de la charge et des éléments.
Ici cela permet
de dire qu’il faut deux fois plus d’ions 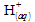
que de zinc (en moles) pour que tous les réactifs disparaissent, ou
qu’il y aura autant de moles de gaz produites que de moles de zinc
consommées.
On remarque aussi
qu’il manque du zinc (7,65 mmol < 50/2 = 25 mmol). On dira que le
zinc est le réactif limitant,
et que la transformation sera
finie quand il aura été completement consommé.
c)En résumé
Etat
|
transformation
|
Etat final
|
II]Tableau d’avancement
1)Le tableau d’avancement est une autre présentation d’une transformation chimique.
L’avancement x
de la réaction est un outil pratique en 3ieme année qui
deviendra indispensable en 5ieme année. L’avancement
x représente le
nombre de moles de produit déja formées depuis le début de la
réaction.
Reprenons
l’équation de la réaction précédente, en notant les ions oxonium 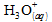 :
:
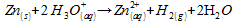 .
.
Les molécules d’eau qui étaient associées aux protons sont libérées
dans la solution.
Equation |
Zn(s) |
+ |
|
+ H2(g) |
+ 2H2O |
coefficients |
1 mol |
2 mol |
1 mol |
1 mol |
2 mol |
Etat |
n1 |
n2 |
0 |
0 |
– |
en cours |
n1 |
n2 |
x |
x |
– |
Etat Final |
n1 |
n2 |
xmax= |
xmax= |
– |
2)Commentaires sur le tableau :
La premiere ligne contient l’équation de la
réaction correctement équilibrée en masse et en charges.Pour remplir la seconde ligne, on calcule le nombre de
moles des différentes especes chimiques dans l’état initial.
En général il n’y a pas encore de produits.
Dans notre cas particulier, l’eau est le solvant de
l’acide donc ce n’est pas la peine de calculer la quantité d’eau
produite lors de la transformation chimique : il y en a
beaucoup (56 moles par litre d’eau) et ce ne sont pas les quelques
millimoles en plus qui vont faire varier son volume.
La troisieme ligne décrit le systeme
chimique en train de réagir.
On choisit
d’appeler x
l’avancement de la réaction le nombre de mole d’ions zinc ou de
dihydrogene déja formés.En fonction des
coefficients stochiométriques
on enleve x
moles de zinc a n1
pour chaque x
moles
d’ion zinc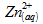 formées
formées
et 2x
moles
d’ions oxonium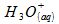 pour
pour
chaque x moles
de dihydrogene formées.
La
derniere ligne décrit l’état final du systeme
chimique : La réaction s’arrete s’il manque un des deux
réactifs. Des deux équations n1
– xmax =
0
et n2
– 2xmax =
0, on
choisit celle qui donne xmax le
plus petit
(sinon il resterait une valeur négative de l’autre réactif...).
Documents joints
- Document (PDF – 410.7 ko)
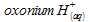 :
:
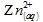 :
: