Physique et Chimie au lycée Jan Neruda de Prague
Vive les sciences !
Accueil > Cours de Chimie > 5ième année > B Equilibre chimique et spontanéité des événements chimiques > 05 Evolutions spontanée vers l’état d’équilibre > 5C2011Chi Ch10 Evolution spontanée vers l’état d’équilibre
5C2011Chi Ch10 Evolution spontanée vers l’état d’équilibre
mardi 13 décembre 2011 par
0. Activité de la page 174
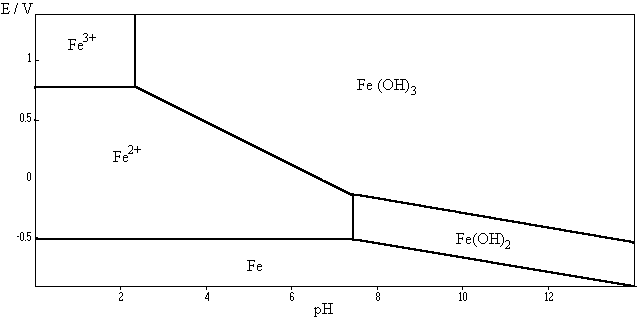
Le chapitre commence fort : en parallèle de vos révisions, voici 3 expériences qui méritent d’être explicitées : les potentiels d’oxydoréduction changent avec le pH, ce qui peut changer le sens de la réaction possible entre les couples Fe3+/Fe2+ et I2/I- comme le montre le graphique ci-dessous (cliquer dessus pour retrouver la page d’origine.).
Expérience 1 :
- La solution de sulfate de fer a été acidifiée. Le potentiel standard I2(aq)/I-(aq) vaut 0,62V (remarque : E(I2(s)/I-(aq) ) = 0,54V) ce qui le place en dessous du couple Fe3+/Fe2+ (potentiel 0,77V pour pH < 2). La réaction ne peut donc pas avoir lieu entre I2(aq) et Fe2+.
Expérience 2 :
- La solution de chlorure de fer III est aussi très acidifiée (sinon on ne pourrait obtenir [Fe3+] = 0,01 mol.L-1à cause d’une précipitation de Fe(OH)3 de Ks = 4×10–38 voir l’énigme du chapitre).
- La réaction suivante a donc lieu : 2Fe3++ 2I-(aq) → 2Fe2++ I2(aq) avec un excès d’iodure de potassium.
- Le diiode formé reste en solution avec l’excès d’ions iodures et forme un ion complexe triiodure I3- de couleur brune. Avec le dichlorométhane de densité 1,3 on réalise une extraction par solvant et en laissant décanter le diiode violet en solution dans le dichlorométhane descend au fond du tube.
- On ajoute alors de la soude concentrée pour éliminer l’acidité puis pour faire apparaître un précipité vert foncé (qui semble noir sur la photo) d’hydroxyde de fer II Fe(OH)2.
Expérience 3 :
- On commence par relever le pH de la solution avec la soude pour avoir 5 < pH < 6. Remarquez sur la courbe que le potentiel du couple Fe3+/Fe2+ est maintenant proche de 0,2V et donc inférieur à celui du couple I2(aq)/I-(aq) : C’est la réaction inverse qui peut avoir lieu !
- 2Fe2++ I2(aq) → 2Fe3++ 2I-(aq) et comme la solution n’est plus assez acide, les ions fer III qui apparaissent précipitent ( Ks(Fe(OH)3) = 4×10–38 voir encore une fois l’énigme du chapitre).
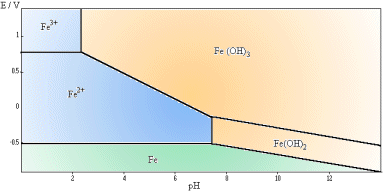
Et comme c’est plus joli en couleur, revoici le diagramme potentiel pH du fer : cliquer sur la courbe pour avoir les commentaires sur la page d’origine sur sciences-en-ligne.com.
1. Critère général d’évolution spontannée
1.1 Calcul du quotient de réaction Qr
1.2 Le critère d’évolution spontanée
2. Illustration du critère d’évolution spontanée
2.1 Cas des réactions acido-basiques
2.2 Cas des réactions d’oxydo réduction
Contact |
Se connecter |
Plan du site |
Mentions légales |
 RSS 2.0 |
Haut de page |
RSS 2.0 |
Haut de page |
 |
|
Physique et Chimie au lycée Jan Neruda de Prague (Lycée Bilingue Jan Neruda)