Physique et Chimie au lycée Jan Neruda de Prague
Vive les sciences !
Accueil > Cours de Chimie > 6ième année > Chapitre 01. Etude expérimentale d’une cinétique de réaction > 6C2009 Ch01 2.1 Réaction entre les ions iodure I- et l’eau oxygénée (péroxyde (...)
6C2009 Ch01 2.1 Réaction entre les ions iodure I- et l’eau oxygénée (péroxyde d’hydrogène) H2O2
dimanche 26 septembre 2010 par
- Nous avons suivi le protocole expérimental de M Jean-Louis Fritsch proposé sur cette page et qui est attaché à l’article pour éviter que l’URL ne change. Merci de ne pas le diffuser sans son accord.
- En plus du protocole de la page 21, il y a des explications sur les ions tri-iodure I3- et une étude des facteurs cinétiques (prochain chapitre)
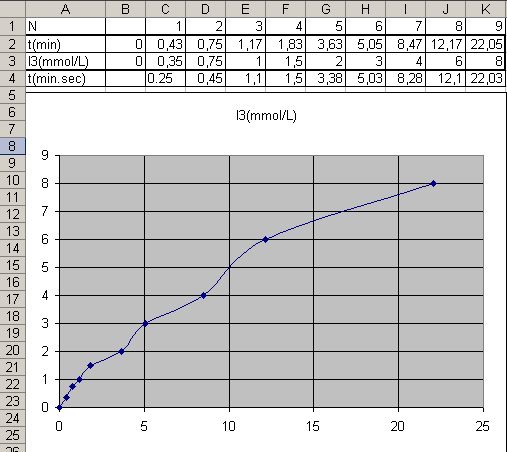
Voici les mesures du premier groupe : Bon exemple de "l’effet serpent", il ne faut PAS relier les points comme le tableur mais tracer une courbe moyenne passant par le seul point connu avec certitude c(t = 0s) = 0 mmol/L
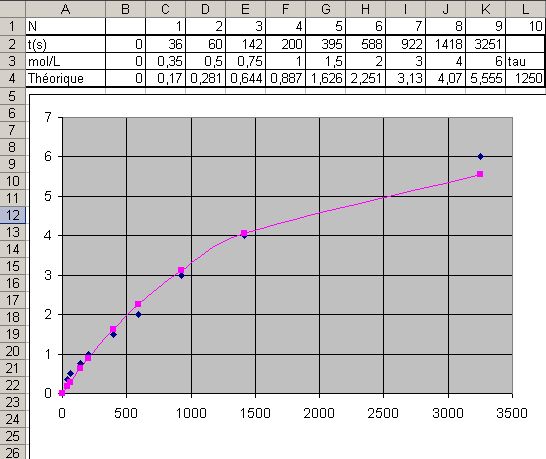
Voici les mesures du second groupe : En plus des points de mesure, j’ai ajouté une courbe théorique de la forme y = A(1-exp(-t/tau)) dont on peut modifier tau dans la dernière colonne du document joint CinetiqueI2 g2.xls
(Le tableur Excel relie les points sans savoir comment ils ont été calculés ce qui explique la forme bizarre de la courbe théorique.)
- Facteurs cinétiques : (en avance sur le prochain cours)
Le second groupe ayant passé 2h dans le labo de chimie, nous avons pu faire quelques manipulations supplémentaires :
Le catalyseur Fe3+ : Le tube a mis ........s pour avoir la couleur du tube de concentration 6 mmol/L au lieu de 588s.
Influence de la température : Le tube placé à 60°C a bruni très rapidement pour obtenir la teinte du tube concentré à 6 mmol/L en .... au lieu de 588s, alors que celui placé dans un mélange d’eau et de glace n’a presque pas évolué dans le même temps.
- Préparation de l’échelle de teintes : comment être efficace ?
Pour savoir combien de solution concentrée à prélever, mieux vaut utiliser un tableur pour raisonner et modifier rapidement les paramètres. Si la quantité à prélever est trop petite et/ou ne correspond pas à une bonne utilisation des pipettes à disposition, alors il faut prendre une solution fille pour continuer les dilutions.
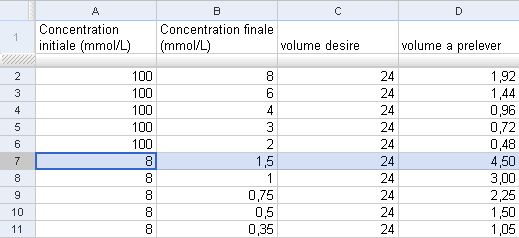
Ici, à partir du sixième tube, j’ai utilisé la première solution fille.
Documents joints
- Protocole expérimental (PDF – 95 ko)
- CinetiqueI2 g2.xls (Excel – 15.5 ko)
Contact |
Se connecter |
Plan du site |
Mentions légales |
 RSS 2.0 |
Haut de page |
RSS 2.0 |
Haut de page |
 |
|
Physique et Chimie au lycée Jan Neruda de Prague (Lycée Bilingue Jan Neruda)