Physique et Chimie au lycée Jan Neruda de Prague
Vive les sciences !
Accueil > Cours de Chimie > 6ième année > Chapitre 01. Etude expérimentale d’une cinétique de réaction > 6CD2010 TP méthode colorimétrique 2/3
6CD2010 TP méthode colorimétrique 2/3
mardi 28 septembre 2010 par
Pendant le TP les élèves réalisent leur échelle de teinte puis mélangent dans un tube à essai identique 10mL de la solution acidifiée d’eau oxygénée à 10 mol.L-1 avec 10 mL de solution d’iodure de potassium à 0,20 mol.L-1 .
Chacun utilisera ses résultats, à comparer avec ceux du livre utilisés ici :
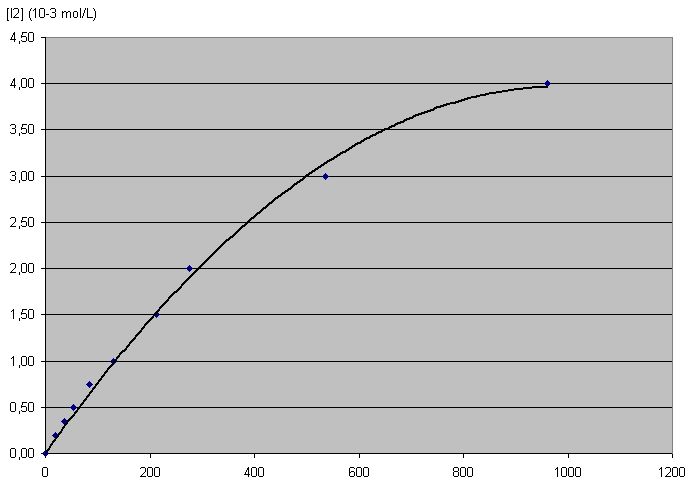
| t (s) | 0 | 20 | 36 | 54 | 84 | 130 | 212 | 276 | 535 | 960 |
| [I2] (10-3 mol.L-1) | 0,00 | 0,20 | 0,35 | 0,50 | 0,75 | 1,0 | 1,5 | 2,0 | 3,0 | 4,0 |
Pour répondre aux questions le jour du TP, il faut déterminer graphiquement les pentes de la courbe obtenue...
ATTENTION : Ici le tableur Excel est trop limité : il ne propose pas de courbe de tendance exponentielle (1-exp(x)). Il ne faut pas comme ci-dessous utiliser une autre forme (ici polynomiale) car on a l’impression que le maximum est atteint alors qu’en traçant à la main ou avec un tableur scientifique comme Regressi on détermine une asymptote à 4,8 mmol/L loin des 4 qui sont en fait la dernière valeur mesurée...
Calcul numérique de la dérivées :
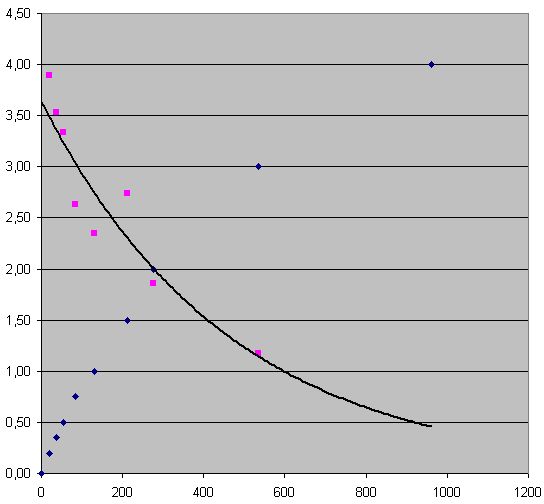
| t (s) | 0 | 20 | 36 | 54 | 84 | 130 | 212 | 276 | 535 | 960 |
| [I2] (10-3 mol.L-1) | 0,00 | 0,20 | 0,35 | 0,50 | 0,75 | 1,0 | 1,5 | 2,0 | 3,0 | 4,0 |
| d[I2]/dt (10-3 mol.L-1.s-1) | 3,89 | 3,53 | 3,33 | 2,63 | 2,34 | 2,74 | 1,86 | 1,17 |
Encore une fois, c’est la déception avec Excel : Les données semblent être trop peu nombreuses, et malgré une courbe de tendance exponentielle, on constate que la dérivée est trop peu précise. Utilisons un logiciel spécialisé : Regressi (version junior)
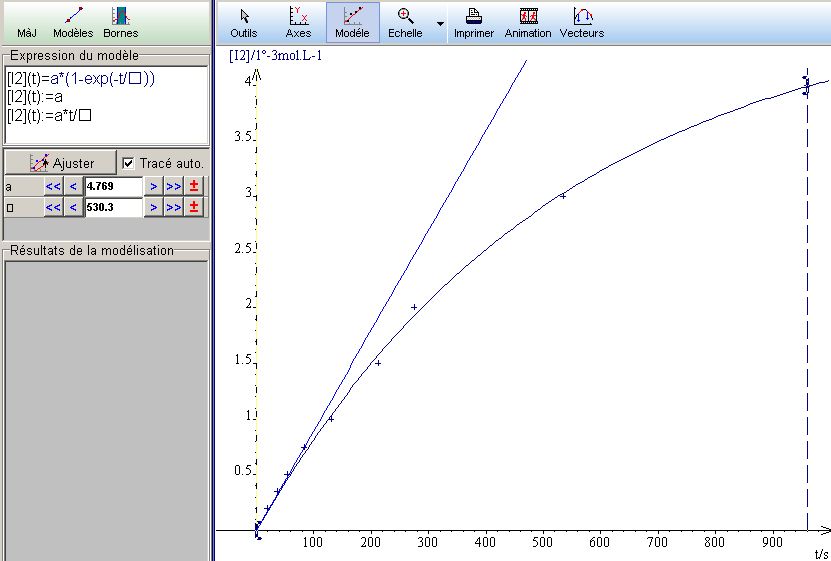
Le modèle proposé est [I2] = 4,8.(1-exp(-t/530).10-3 . En le replaçant dans le tableur, les points proposés collent aux points de mesure, en particulier au dernier point...
On a donc par définition [I2temps infini] = 4,8.10-3 mol/L et le temps de demi-réaction vaut 530xln(2) = 367s = 6 min 7s.
Après le passage du 1ier groupe, j’ajoute le fichier "apparition du diiode.xls" (voir onglet Groupe 1)
Remarques :
- Après avoir préparé et essayé les solutions j’ai constaté que la quantité de peroxyde d’hydrogène était insuffisante (il y a un excès d’ions iodure et la solution ne se colore pas assez). A la dernière minute, j’ai "dopé" la solution avec 10 ml d’eau oxygénée à moins de 3% (car restée au chaud pendant l’été). Le résultat est que la réaction s’est passée plus vite...
- Le tableur spécialisé Regressi Junior ne m’avait pas complètement satisfait : j’ai donc modélisé directement la courbe dans le tableur Excel avec la formule y = A(1-e-t/tau)

- En déplaçant les curseurs, on peut ajuster les valeurs de A et de tau. Les valeurs proposées par le Regressi Junior donne un écart supérieur mais surtout passe par le dernier point. Les valeurs que j’ai choisies donnent l’écart moyen le plus proche de 0 et passent donc bien au milieu de tous les points.
Documents joints
- apparition du diiode.xls (Excel – 39 ko)
Contact |
Se connecter |
Plan du site |
Mentions légales |
 RSS 2.0 |
Haut de page |
RSS 2.0 |
Haut de page |
 |
|
Physique et Chimie au lycée Jan Neruda de Prague (Lycée Bilingue Jan Neruda)