Physique et Chimie au lycée Jan Neruda de Prague
Vive les sciences !
Accueil > Cours de Chimie > 5ième année > A Transformations des systèmes chimiques > 04 Titrages pH-métriques > 5C2011 TP Dosage 3 en 1 du vinaigre
5C2011 TP Dosage 3 en 1 du vinaigre
dimanche 13 novembre 2011 par
Pour des raisons de temps, mais aussi parce que nos sondes pH-métriques sont pour la plupart "fatiguées", nous allons utiliser la colorimétrie, la conductimétrie et la ph-métrie en même temps !
1. Matériel et solution :
- On utilise une burette munie d’une pince et pas d’un robinet car elle sera remplie de soude de concentration cb = 0,1 mol.L-1.
- La sonde combinée doit être bien nettoyée à l’eau puis à l’eau distillée avant l’étalonnage avec la solution étalon à 1413 µS/m et avec la solution tampon à pH = 4 ou 7.
- Le vinaigre a déjà été dilué au dixième. On en prélèvera va = 10 mL avec une pipette que l’on placera dans un bécher de 250 mL avec 100mL d’eau distillée pour encore le diluer et éviter que le barreau magnétique ne heurte la sonde combinée pH- et conducti-mètre.
- L’indicateur coloré utilisé est la phénolphtaleïne :
forme acide
incolorezone de virage
pH 8,2 à pH 10,0forme basique
rose
2. Préparation du montage et mode opératoire :
- Faire le montage sans oublier de placer un bécher de sécurité/poubelle. Vérifier que la pince est bien en place et rincer la burette avec la solution de soude. Remplir alors la burette en faisant attention de ne pas avoir de bulle près de la pince avant de régler le 0.
Attention : Il faut avoir les yeux au niveau des graduations et pas regarder par en dessous ! - Placer le barreau magnétique dans le bécher et l’agitateur sous la burette. Démarrer l’agitation en faisant attention de ne pas aller trop vite :
Si des gouttes sont projetées sur les parois, elles ne participeront pas à la réaction ! - Placer la sonde de manière à ce qu’elle soit complètement immergée mais pas trop près du barreau pour éviter de casser l’électrode de verre du ph-mètre.

- Faire couler mL par mL au début en laissant à chaque fois le temps à l’agitateur de bien mélanger et donc d’avoir une valeur constante sur le conductimètre/pH-mètre. En s’approchant de la zone de virage, changer de stratégie : le pH va varier très vite près du point d’inflexion !
Ajouter alors tout doucement l’hydroxyde de sodium pour obtenir des valeurs de pH permettant de tracer la courbe précisément.
Une fois la couleur rose obtenue, lorsque le pH variera plus lentement donc on pourra reprendre l’écoulement mL par mL.
3. Résultats et exploitation :
- Rassembler les résultats dans le tableau ci-dessous :
| Vb (mL) | 0 | ||||||||||||||||||
| pH | |||||||||||||||||||
| σ (mS/cm) |
- Faire le dessin du montage en précisant le nom du matériel utilisé.
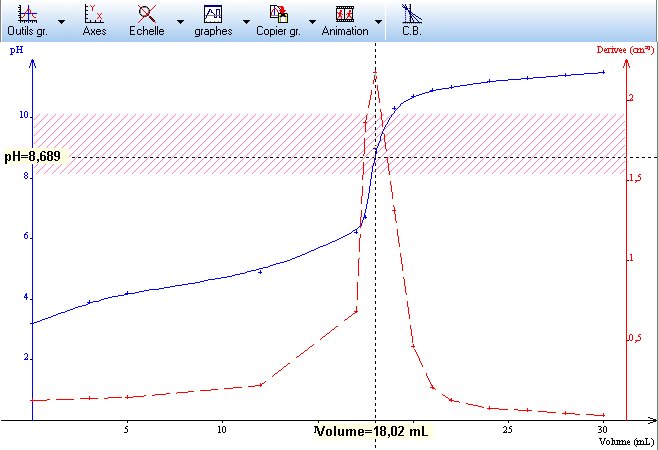
- Dessiner sur un même graphique pH = f(Vb) et σ = f(Vb). Utiliser pour chaque courbe une méthode graphique pour déterminer le volume à l’équivalence VbE. Lire les valeurs de la conductivité et du pH sur le graphique.
- Quel est le pH de la solution à l’équivalence ? Justifier l’emploi de la phénolphtaléine pour un dosage colorimétrique.
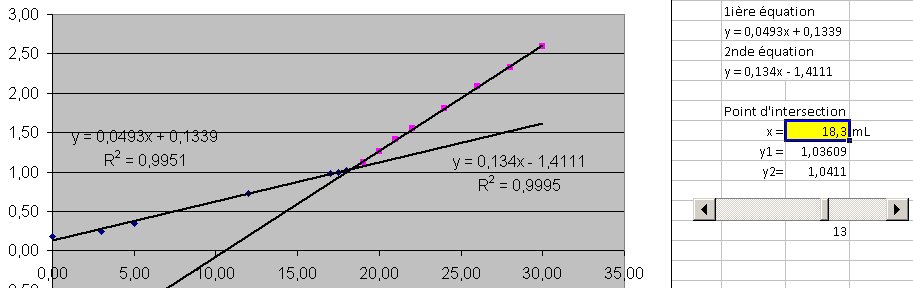
- Déterminer à l’aide de la courbe, le pKA du couple CH3COOH/ CH3COO-. Justifier la réponse.
Pour vous entraîner à bien dessiner, vous devez faire la courbe de pH à la main ! Si vous étiez absent ou que le pH-mètre n’a pas bien fonctionné prenez les données du fichier ci-joint.
Remarques :
a) la courbe de dérivée n’est pas bonne car dpH/dV ≈ ΔpH/ΔV que si les écarts sont assez petit. Le tableau scientifique Regressi va interpoler les points nécessaires pour donner un bon résultat. Allez sur cette page pour le télécharger et voir comment on s’en sert dans ce cas précis.
b) La conductimétrie donne rapidement un bon résultat du volume à l’équivalence mais il faudra calculer le pH à l’équivalence avec le volume total de la solution et les conductivités molaires ioniques.
Documents joints
- 5C2011TPDosagepH_Evelina K.xls (Excel – 38.5 ko)
-
5C2011TPDosagepH_Evelina K.rw3.zip
(Zip – 798 octets)
A renommer en .rw3 !!!
Contact |
Se connecter |
Plan du site |
Mentions légales |
 RSS 2.0 |
Haut de page |
RSS 2.0 |
Haut de page |
 |
|
Physique et Chimie au lycée Jan Neruda de Prague (Lycée Bilingue Jan Neruda)