Physique et Chimie au lycée Jan Neruda de Prague
Vive les sciences !
Accueil > Cours de Chimie > 5ième année > A Transformations des systèmes chimiques > 03 Transformations associées à des réactions acido-basiques > 5C2011 TP Quel est le meilleur donneur de protons ?
5C2011 TP Quel est le meilleur donneur de protons ?
lundi 17 octobre 2011 par
(Inspiré du livre Nathan Chimie TermS collection Tomasino)
A. Solubilité et nature acido-basique :
1. acide benzoïque :
- Dissoudre, à l’aide de l’agitateur magnétique, 500 mg d’acide benzoïque dans un erlenmeyer A contenant 100 mL d’eau distillée. Que constatez-vous ?
- Mesurer le pH de la solution à l’aide d’un papier pH.
- Ecrire l’équation de la réaction rendant compte du pH de la solution.
2. benzoate de sodium :
- Même protocole avec 1,0 g de benzoate de sodium. On appellera B cet erlenmeyer pour la suite des opérations.
B.Comparaison des acides méthanoïques et éthanoïques
1. Dans un erlemeyer C, dissoudre à nouveau 1,0 g de benzoate de sodium dans 100 mL d’eau distillée. Ajouter quelques gouttes d’indicateur coloré dans les erlenmeyer B et C.
2. Ajouter progressivement à l’aide d’une pipette graduée 7,0 mL d’acide méthanoïque de concentration 1,0 mol.L dans l’erlenmeyer B. Observer.
3. Ajouter progressivement à l’aide d’une pipette graduée 7,0 mL d’acide éthanoïque de concentration 1,0 mol.L dans l’erlenmeyer C. Observer.
Questions :
a) Ecrire dans chaque cas l’équation de la réaction effectuée.
b) Comparer les taux d’avancement de ces deux réactions
c) Conclure en comparant l’aptitude de l’acide méthanoïque et de l’acide éthanoïque à transférer leur proton à l’ion benzoate.
Données (d’après Wikipédia) :
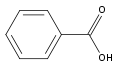 Solubilité dans l’eau à 20 °C : 2,9 g/L
Masse volumique : 1,3 kg/L
 Xn
|
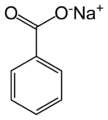 pKa = 4,2 (25 °C)
Masse molaire = 144,1 g∙mol-1
Solubilité dans l’eau à 20 °C : 630 g/L
Masse volumique : 1,44 g.cm-3
|
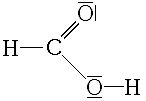 pKa = 3,751 (25 °C)
Masse molaire = 46,0 g∙mol-1
Solubilité dans l’eau à 25 °C : 1000 g/L
Densité : 1,22 à 25°C
 C
|
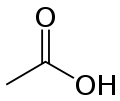 pKa = 4,76 (25 °C)
Masse molaire = 60,1 g∙mol-1
Solubilité dans l’eau à 25 °C : très miscible
Densité : 1,0495 à 20°C
 C
|
Contact |
Se connecter |
Plan du site |
Mentions légales |
 RSS 2.0 |
Haut de page |
RSS 2.0 |
Haut de page |
 |
|
Physique et Chimie au lycée Jan Neruda de Prague (Lycée Bilingue Jan Neruda)