Physique et Chimie au lycée Jan Neruda de Prague
Vive les sciences !
Accueil > Cours de Chimie > 5ième année > A Transformations des systèmes chimiques > 03 Transformations associées à des réactions acido-basiques > 5C2011 TP virtuel sur la spectrophotométrie (1ière partie)
5C2011 TP virtuel sur la spectrophotométrie (1ière partie)
mercredi 3 octobre 2012 par
Comme nous n’avons pas de spectrophotomètre  ou de colorimètre
ou de colorimètre  au lycée, nous utiliserons une simulation informatique.
au lycée, nous utiliserons une simulation informatique.
 ou de colorimètre
ou de colorimètre  au lycée, nous utiliserons une simulation informatique.
au lycée, nous utiliserons une simulation informatique.- Le spectrophotomètre fonctionne avec un prisme qui décompose la lumière, une fente pour sélectionner une longueur d’onde et une cellule photoélectrique qui reçoit plus ou moins de lumière suivant que l’échantillon absorbe ou non cette couleur.
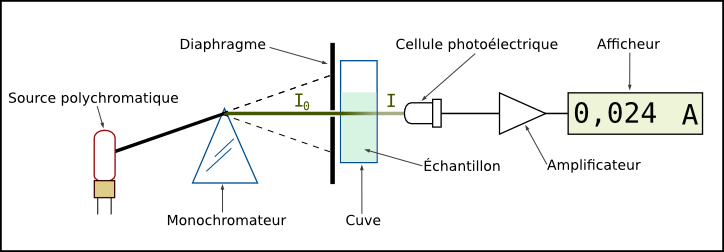
- Le colorimètre à filtre est plus basique car un simple filtre quasi-monochromatique s’insère entre la source lumineuse et le capteur. Il s’utilise avec un voltmètre
 ou avec un système de mesures informatisé pour obtenir directement une courbe.
ou avec un système de mesures informatisé pour obtenir directement une courbe.
- Le spectrophotomètre mesure l’absorbance de la solution A = -log T avec T la transmittance de la solution.
- T = Intensité lumineuse transmise par la solution colorée/Intensité lumineuse transmise par le solvant transparent.
- De cette manière si ces deux intensités sont égales, alors T = 1 = 100 et l’absorbance vaut A = log 100 = 0
- Pour A = 1 la solution absorbe 90% de l’intensité lumineuse et pour A = 2, elle en absorbe 99%.
- La loi de Beer-Lambert stipule que l’absorbance est proportionnelle à la concentration de la solution. Si la lumière est monochromatique, la solution homogène et pas trop concentrée, le soluté ne réagissant pas avec le solvant pendant la mesure : A = k.c = ελ.l.c (avec ελ le coefficient d’extinction molaire pour la longueur d’onde λ et l la longueur traversée par la lumière dans la cuve).
- Avec une solution étalon (de concentration c connue), on peut mesurer k = Amesurée/c et mesurer ensuite des concentrations inconnues.
- Si le spectrophotomètre ne chauffe pas la solution ou ne favorise pas une réaction photosensible, on peut étudier la cinétique d’une réaction.
Les exercices n° 6, 7, 11 et 14 P79 sont à faire à la maison.
- Ouvrez maintenant le Spectrophotomètre virtuel d’Adrien Wilm de l’Académie de Lille et prenez la page 139 du manuel Nathan TermS collection Tomasino.
- Après avoir essayé le spectrophotomètre et compris son fonctionnement, revenez sur la loi de Beer-Lambert pour un mélange de plusieurs espèces absorbantes sur cette page de Wikipedia.
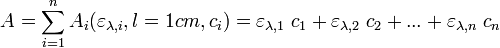
- Lisez la première partie "Réflexion préalable" et faites les démonstrations demandées.
Contact |
Se connecter |
Plan du site |
Mentions légales |
 RSS 2.0 |
Haut de page |
RSS 2.0 |
Haut de page |
 |
|
Physique et Chimie au lycée Jan Neruda de Prague (Lycée Bilingue Jan Neruda)