Physique et Chimie au lycée Jan Neruda de Prague
Vive les sciences !
Accueil > Cours de Chimie > 6ième année > Séminaire de Chimie en français > Mélanges azeotropique : séparation de l’eau et de l’éthanol
Mélanges azeotropique : séparation de l’eau et de l’éthanol
jeudi 5 janvier 2012 par
Voici les liens vers les pages que j’ai utilisées pour vous présenter ce sujet :
- L’expérience associée est la distillation du vin : Peut-on séparer l’eau et l’éthanol ? Cette page montre l’expérience et on peut voir que les premières gouttes de distillat contiennent 50% d’alcool en masse mais que ce pourcentage diminue alors que la température d’ébullition augmente.
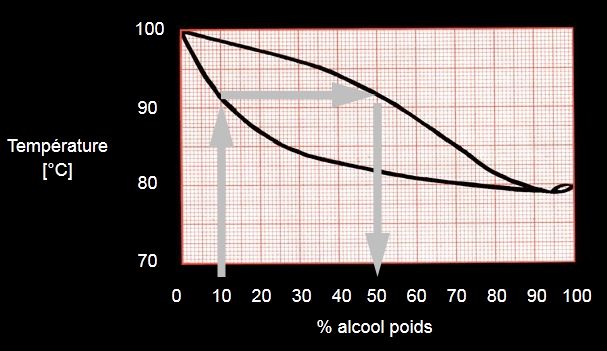
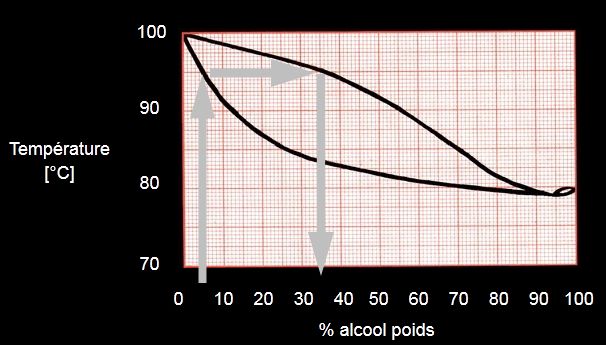
- Pour comprendre ces courbes, nous avons utilisé cette page sur les azéotropes : Plus la solution de départ est concentrée, plus le distillat sera concentré mais par distillations successives on arrive au mélange azéotropique 96% d’alcool pour 4% d’eau qui bout à une température inférieure à la plus basse des deux températures d’ébullitions (azéotropisme positif).
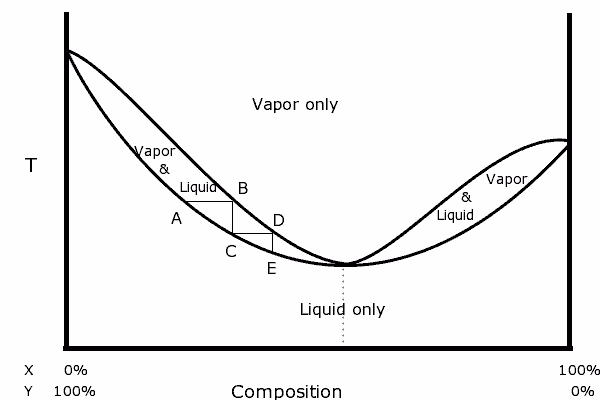
- Pour dépasser ce point il faut briser l’azéotrope comme le montre cette page. Voici enfin une liste de mélanges azéotrpes.
- Voici enfin un exercice corrigé où vous retrouverez le diagramme inversé car en fonction du pourcentage d’eau dans un mélange eau + éthanol. Cet exercice commence avec le volume du mélange qui est inférieur à la somme des volumes d’eau et d’éthanol à cause des liaisons hydrogènes, également à l’origine de l’azéotrope.
Contact |
Se connecter |
Plan du site |
Mentions légales |
 RSS 2.0 |
Haut de page |
RSS 2.0 |
Haut de page |
 |
|
Physique et Chimie au lycée Jan Neruda de Prague (Lycée Bilingue Jan Neruda)