Physique et Chimie au lycée Jan Neruda de Prague
Vive les sciences !
Accueil > Cours de Chimie > 5ième année > B Equilibre chimique et spontanéité des événements chimiques > 06 Les piles, fonctionnement en générateur électrique > 5D Tp-cours sur les piles
5D Tp-cours sur les piles
dimanche 14 mars 2010 par
Réalisation de piles et mesures
1. Avec différentes demi-piles
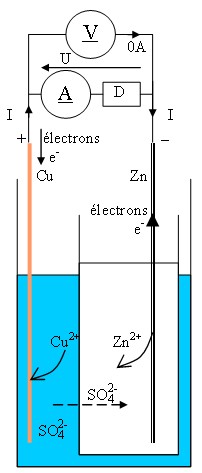
1.1 pile - Zn2+/Zn//Cu2+/Cu +
 |
|
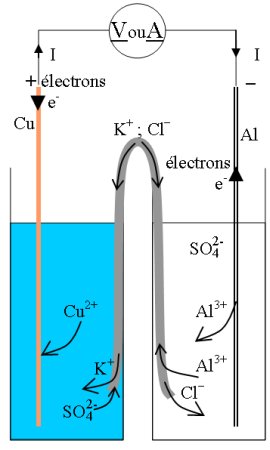
1.2 pile - Al3+/Al//Cu2+/Cu +
|
 |
1.3 pile - Al3+/Al//Zn2+/Zn +
- Si on répète la même opération avec ces deux demi-piles, la force électromotrice mesurée vaut E" = 0,38V. Il semble que l’oxyde d’aluminium présent sur la plaque intervient et donc que la f-é-m n’est pas celle attendue...
- On vérifie quand même E’ + E" = 0,38 + 0,64 = 1,02 V ≈ E
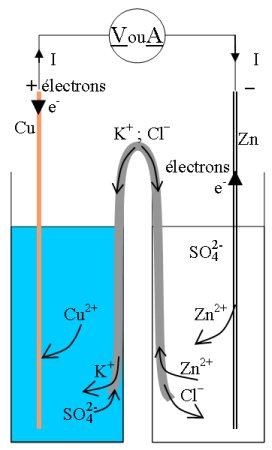
2. Influence du pont ionique
- Avec un pont ionique constitué d’un papier imbibé de solution saturée de chlorure de potassium de largeur 2 cm, on mesure E = 1,05V et Icc = 0,27 mA (à comparer avec les 45 mA obtenus avec la paroi poreuse !)
- En augmentant la largeur de la bande de la bande de papier (largeur 5 cm) on mesure la même valeur de E et Icc = 0,50 mA. La résistance interne a donc diminué.
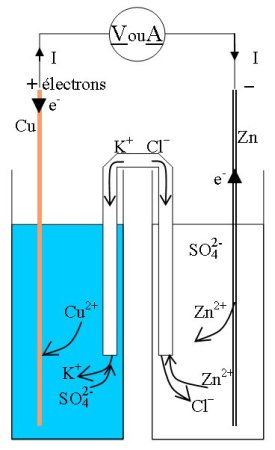
- Avec un pont ionique constitué d’un tube en U rempli d’une solution saturée de chlorure de potassium gélifiée (avec de l’amidon) de diamètre 1 cm, la tension à vide reste la même, mais le courant maximum Icc vaut 3,5 mA (toujours bien moins bon que la paroi poreuse).
 |
 |
3. Piles en série
On place la pile à paroi poreuse et avec le tube en U en série. La tension à vide vaut 2,08V et le courant de court-circuit 9 mA. De quoi allumer une diode électroluminescente qui commence à briller pour U = 1,8V.
Contact |
Se connecter |
Plan du site |
Mentions légales |
 RSS 2.0 |
Haut de page |
RSS 2.0 |
Haut de page |
 |
|
Physique et Chimie au lycée Jan Neruda de Prague (Lycée Bilingue Jan Neruda)