Physique et Chimie au lycée Jan Neruda de Prague
Vive les sciences !
Accueil > Cours de Chimie > 3ième année > C Transformation de la matière > 22 Solutions et concentration molaire > TP dissolution et effets thermiques (n°1)
TP dissolution et effets thermiques (n°1)
lundi 18 octobre 2010 par
1. Mise en solution de solides ioniques
| NaCl | NH4Cl | NaOH | CuSO4 anhydre | CuSO4 pentahydraté |
Ne pas oublier de faire la tare pour éliminer la masse du sabot de pesée !
b) Quels sont les ions et molécules contenus dans ces solides ?
Le sel de cuisine NaCl contient les ions sodium Na+ et chlorure Cl-, NH4Cl les ions ammonium NH4+ et chlorure, la soude NaOH les ions sodium et hydroxyde OH-, CuSO4 anhydre les ions cuivre II Cu2+ et sulfate SO42- et le sulfate de cuivre pentahydraté contient en plus 5 molécules d’eau H2O.
c) Comment obtenir exactement 10 mL de solution ?
- Verser le contenu du sabot de pesée dans une éprouvette graduée adaptée et le rincer avec de l’eau distillée pour ne pas en perdre.
- Agiter pour dissoudre le solide ionique et compléter le niveau une fois la dissolution terminée.
d) Réaliser la solution et mesurer la variation de température.
Nous avons mesuré les variations de température suivante (à compléter, merci)
| Solide ionique | NaCl | NH4Cl | NaOH | CuSO4 anhydre | CuSO4 pentahydraté |
| Variation de température | 0°C | - °C | + °C | + °C | 0°C |
e) Toutes ces solutions ont le même titre massique : 1g pour 10mL donc 100g/L mais quelles sont leurs concentrations ?
- M(NaCl) = 23 + 35,5 = 58,5 g/mol d’où n = 1/58,5 = 17,1 mmol dissoutes dans 10 mL d’eau donc c = n/v = 0,0171/0,01 = 1,71 mol.L-1 .
- On fait de même pour les autres solides ioniques :
| Solide ionique | NaCl | NH4Cl | NaOH | CuSO4 anhydre | CuSO4 pentahydraté |
| Masse molaire (g/mol) | 58,5 | 53,5 | 40,0 | 159,6 | 249,6 |
| Concentration (mol/L) | 1,71 | 1,87 | 2,50 | 0,627 | 0,401 |
2. Exploitation
a) Ecrire l’équation de la dissolution donnant les ions solvatés (aqueux) contenus dans le solide.
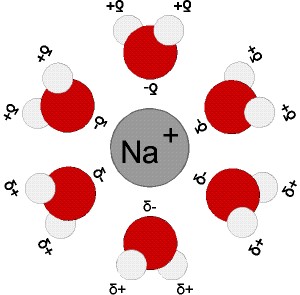
- NaCl + nH2O → Na+(aq) + Cl-(aq)
- NH4Cl + nH2O → NH4+(aq) + Cl-(aq)
- NaOH + nH2O → Na+(aq) + HOl-(aq)
- CuSO4 + nH2O → Cu2+(aq) + SO42-(aq)
- (CuSO4 ; 5H2O )+ nH2O → Cu2+(aq) + SO42-(aq)
b) Comment interpréter les effets thermiques observés ? En déduire ce qu’est une liaison ionique, de solvatation ou une liaison en général du point de vue énergétique.
- Le fait que le bilan énergétique peut être positif (dissolution exothermique), nul (athermique) ou négatif (endothermique) montre qu’il y a deux phases dans la dissolution.
- La première phase de destruction du cristal et des liaisons ioniques consomme logiquement de l’énergie et la seconde phase de solvatation des ions doit donc en fournir.
- Former des liaisons libère de l’énergie pour assurer une certaine stabilité : pour revenir en arrière il faudra fournir cette même énergie.
exemple de l’ion sodium hydraté Na+(aq)

Contact |
Se connecter |
Plan du site |
Mentions légales |
 RSS 2.0 |
Haut de page |
RSS 2.0 |
Haut de page |
 |
|
Physique et Chimie au lycée Jan Neruda de Prague (Lycée Bilingue Jan Neruda)
